澳洲TGA:介紹
TGA 是Therapeutic Goods Administration的簡寫,全稱是治療商品管理局,它是澳大利亞的治療商品(包括藥物、醫療器械、基因科技和血液制品)的監督機構。依據1989年的治療商品法案,TGA是遞屬于澳大利亞政府健康和老齡部下的一個部門。TGA開展一系列的評審和監督管理工作,以確保在澳大利亞提供的治療商品符合適用的標準,并保證澳大利亞社會的治療水平在一個較短的時間內達到較高的水平。管制的框架是以確定公眾的健康和安全管理為基礎設計的, 同時也減輕企業任何不必要的管制負擔。事實上,管制要求對任何產品進入澳大利亞生產或銷售前,必須先通過“澳大利亞最佳治療法案登記” Australian register of therapeutic goods (ARTG)。ARTG是經核準產品已經符合人體安全需要的計算機數據庫。
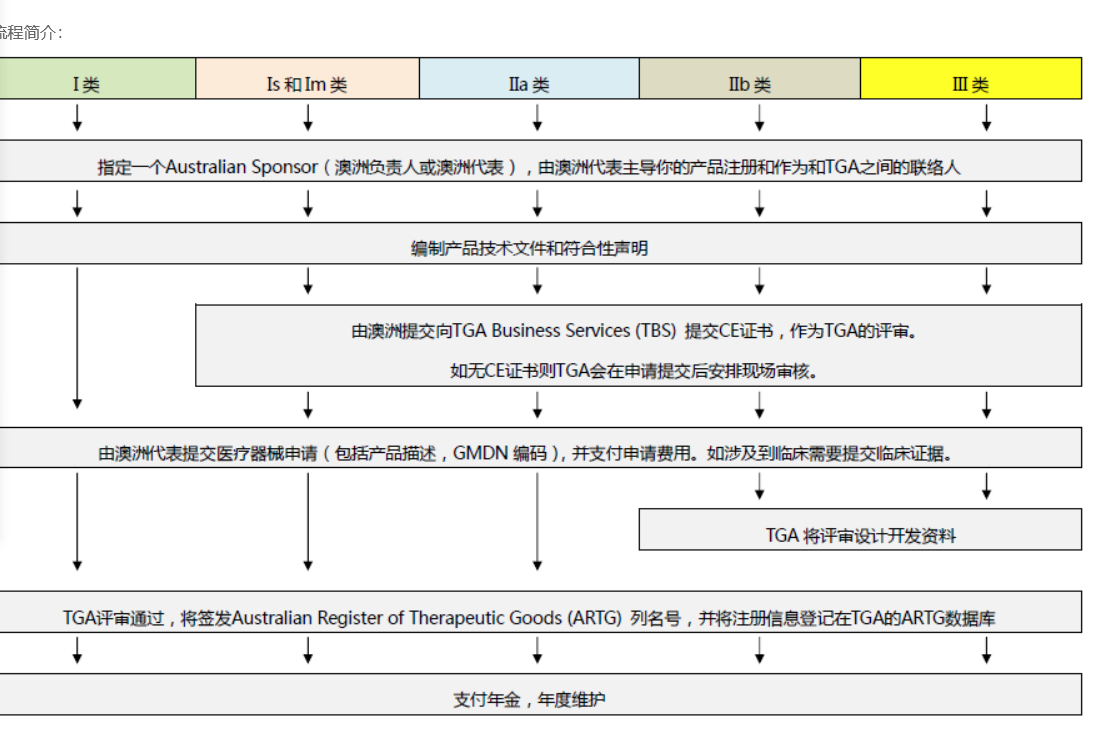
醫療器械的分類和注冊流程
依據Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,產品的分類幾乎和歐盟分類一致,如果貴公司產品已經獲得CE標志,則產品類別可以按照CE分類。如果已經獲得歐盟公告機構(Notified Body)簽發的CE證書,是可以被TGA認可的,并可以作為滿足澳大利亞安全法規的重要注冊資料。
TGA認證流程